পরমাণুর গঠন ও রাদারফোর্ড, বোর মডেল — Best (Atomic Structure in Bangla) SSC 2026
পরমাণুর গঠন ও রাদারফোর্ড, বোর মডেল! পৃথিবীর সমস্ত পদার্থই গঠিত হয়েছে ক্ষুদ্রাতিক্ষুদ্র কণিকা— পরমাণু দ্বারা। চোখে দেখা না গেলেও এই পরমাণুই হলো সমস্ত পদার্থের মৌলিক একক। বিজ্ঞানের ইতিহাসে পরমাণুর গঠন ও এর অভ্যন্তরীণ বিন্যাস নিয়ে অসংখ্য গবেষণা হয়েছে। রসায়ন বিজ্ঞানের ৩য় অধ্যায়ের (পার্ট ২) পরমাণুর গঠন ও রাদারফোর্ড, বোর মডেল নিয়ে আমরা সম্পূর্ণ আলোচনা করেছি। আপনি এই নোট পড়লে আপনাকে গাইড কিনতে হবে না। আশা করি আপনাদের উপকারে আসবে।
আমাদের এই পেইজটি বুকমার্ক করে রাখতে পারেন। পরবর্তী অংশগুলো আপনারা এই সাইট থেকে পড়তে পারবেন। ৩য় অধ্যায়ের (পার্ট ১)
ডাল্টনের কঠিন গোলক মডেল থেকে শুরু করে রাদারফোর্ডের নিউক্লিয়াস তত্ত্ব, এরপর বোরের শক্তিস্তর মডেল — প্রতিটি ধাপই আমাদের পরমাণু সম্পর্কে জ্ঞানের গভীরতা বাড়িয়েছে।
রাদারফোর্ড তাঁর স্বর্ণপাত পরীক্ষার মাধ্যমে নিউক্লিয়াস বা কেন্দ্র আবিষ্কার করে বিজ্ঞানের এক নতুন দিগন্ত উন্মোচন করেন। পরে নীলস বোর তাঁর কক্ষপথ ও শক্তিস্তর তত্ত্ব দিয়ে পরমাণুর স্থায়িত্ব ও বর্ণালী ব্যাখ্যা করেন, যা আধুনিক কোয়ান্টাম তত্ত্বের ভিত্তি স্থাপন করে।
আজকের এই আলোচনায় আমরা সহজ ভাষায় বুঝব —
পরমাণুর গঠন কীভাবে হয়, রাদারফোর্ড ও বোরের মডেলের মধ্যে পার্থক্য কোথায়, ইলেকট্রন কীভাবে বিভিন্ন শক্তিস্তরে বিন্যস্ত থাকে, এবং কীভাবে এসব তত্ত্ব আধুনিক পদার্থবিজ্ঞানের ভিত্তি তৈরি করেছে।
এই নিবন্ধটি পড়লে আপনি পাবেন—
- পরমাণুর গঠন সম্পর্কিত স্পষ্ট ধারণা
- রাদারফোর্ড ও বোর মডেলের তুলনা
- ইলেকট্রন বিন্যাস, শক্তিস্তর ও অরবিটালের ধারণা
- আইসোটোপ ও পারমাণবিক ভর নির্ণয়ের নিয়ম
সংক্ষেপে বলা যায়, এই অধ্যায়টি শুধু রসায়নের নয়, আধুনিক বিজ্ঞানের ভিত্তিপ্রস্তর।
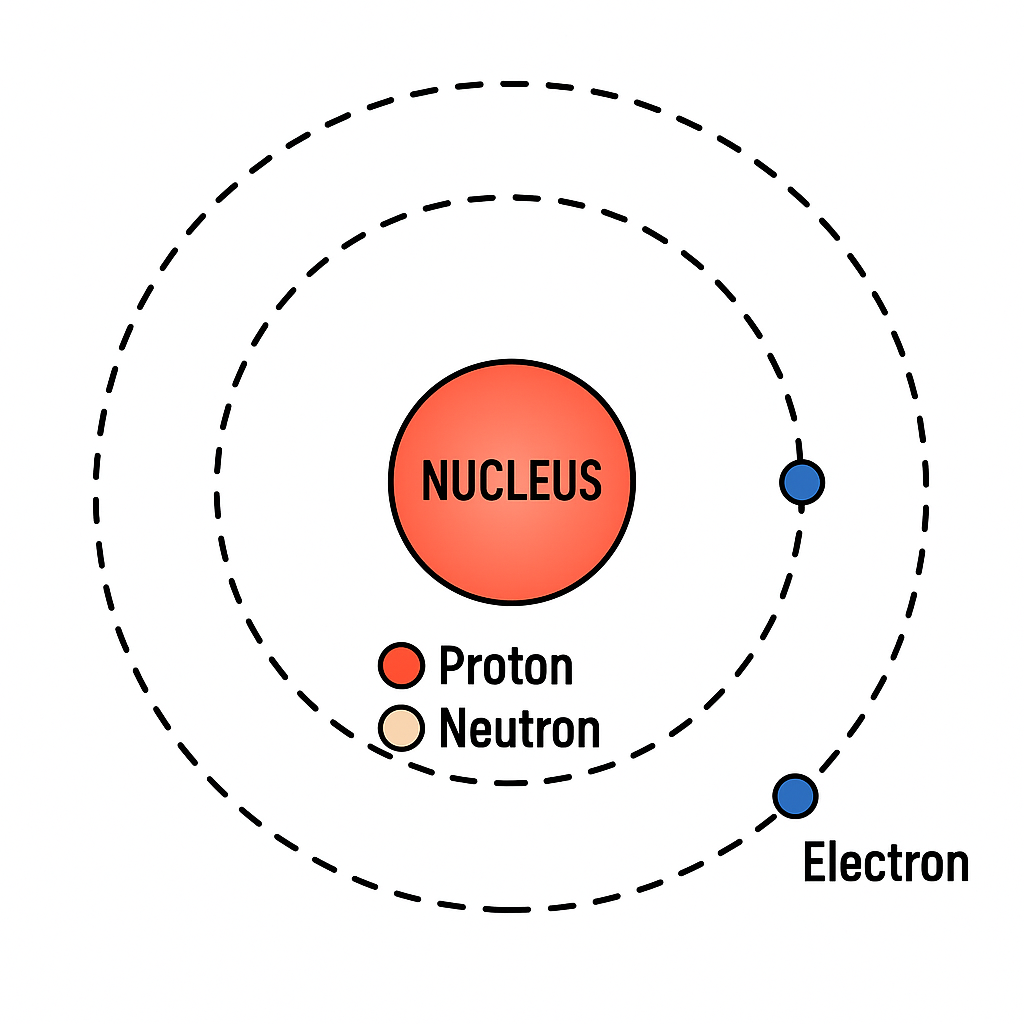
🔬 পরমাণুর গঠন (Atomic Structure)
পরমাণু কী?
পরমাণু হলো পদার্থের অতি ক্ষুদ্র কণা যা রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে কিন্তু রাসায়নিকভাবে ভাঙা যায় না। প্রতিটি মৌলের নিজস্ব পরমাণু আছে, যার কেন্দ্রে নিউক্লিয়াস (proton + neutron) এবং চারপাশে ইলেকট্রন ঘূর্ণায়মান থাকে।
⚛️ ৩.৬ পরমাণুর মডেল (Atomic Models)
রাদারফোর্ডের পরমাণু মডেল (Rutherford Atomic Model)
রাদারফোর্ডের পরীক্ষার সংক্ষিপ্ত বিবরণ:
১৯১১ সালে আর্নেস্ট রাদারফোর্ড স্বর্ণপাত পরীক্ষা (Gold Foil Experiment) করে পরমাণুর একটি মডেল প্রস্তাব করেন।
🧩 রাদারফোর্ড মডেলের মূল বিষয়সমূহ:
- পরমাণুর কেন্দ্রে একটি ঘন নিউক্লিয়াস থাকে যেখানে ধনাত্মক প্রোটন ও নিরপেক্ষ নিউট্রন থাকে।
- নিউক্লিয়াসের চারপাশে ইলেকট্রনরা কক্ষপথে ঘোরে।
- পরমাণুর অধিকাংশ ভর নিউক্লিয়াসে কেন্দ্রীভূত।
- নিউক্লিয়াস ও ইলেকট্রনের মধ্যে আকর্ষণ বল বিদ্যমান।
🔻 রাদারফোর্ড মডেলের সীমাবদ্ধতা:
- ইলেকট্রন কক্ষপথে ঘূর্ণায়মান থাকলে শক্তি ক্ষয় হওয়ার কথা, ফলে পরমাণু ধ্বসে পড়া উচিত।
- পরমাণুর স্থায়িত্ব ব্যাখ্যা করতে ব্যর্থ।
- পরমাণুর বর্ণালী (spectrum) ব্যাখ্যা করতে পারেনি।
পদার্থের গঠন (Structure of Matter) রসায়ন বিজ্ঞান ৩য় অধ্যায় এস এস সি 2026
বোরের পরমাণু মডেল (Bohr’s Atomic Model)
১৯১৩ সালে নীলস বোর রাদারফোর্ডের মডেল সংশোধন করে নতুন তত্ত্ব দেন।
🧠 বোরের মডেলের মূল ধারণা:
(a) ইলেকট্রন নির্দিষ্ট কক্ষপথে (energy level) ঘোরে, যাকে stationary orbit বলে।
(b) প্রতিটি কক্ষপথের শক্তি নির্দিষ্ট।
(c) ইলেকট্রন যখন এক শক্তিস্তর থেকে অন্য স্তরে যায় তখন শক্তি শোষণ বা বিকিরণ (Emission/Absorption) করে।
🧮 বোর সূত্র:
[
mvr = \frac{nh}{2\pi}
]
যেখানে,
m = ইলেকট্রনের ভর
v = বেগ
r = কক্ষপথের ব্যাসার্ধ
n = প্রধান কোয়ান্টাম সংখ্যা
h = প্ল্যাঙ্ক ধ্রুবক
শক্তিস্তর পরিবর্তনের সময় শক্তি নির্গমন
[
h\nu = \frac{hc}{\lambda}
]
বোর মডেলের সাফল্য:
- হাইড্রোজেন পরমাণুর বর্ণালী ব্যাখ্যা করতে সক্ষম হয়েছিল।
- পরমাণুর স্থায়িত্ব ব্যাখ্যা করতে সক্ষম।
- শক্তিস্তরের ধারণা প্রতিষ্ঠিত করে।
🔻 সীমাবদ্ধতা:
- বহু ইলেকট্রন বিশিষ্ট পরমাণুতে প্রযোজ্য নয়।
- ইলেকট্রনের অরবিটাল আকার ব্যাখ্যা করতে পারেনি।
ইলেকট্রন বিন্যাসের মূল ধারণা:
বোরের মডেল অনুযায়ী প্রতিটি শক্তিস্তরে সর্বাধিক ইলেকট্রন থাকে = 2n²
| শক্তিস্তর | n | সর্বাধিক ইলেকট্রন সংখ্যা | নাম |
|---|---|---|---|
| K | 1 | 2 | প্রথম শক্তিস্তর |
| L | 2 | 8 | দ্বিতীয় শক্তিস্তর |
| M | 3 | 18 | তৃতীয় শক্তিস্তর |
| N | 4 | 32 | চতুর্থ শক্তিস্তর |
🧩 মৌলগুলোর ইলেকট্রন বিন্যাস (H থেকে Zn পর্যন্ত)
| মৌল | পারমাণবিক সংখ্যা | K | L | M | N |
|---|---|---|---|---|---|
| H | 1 | 1 | |||
| He | 2 | 2 | |||
| Li | 3 | 2 | 1 | ||
| Be | 4 | 2 | 2 | ||
| B | 5 | 2 | 3 | ||
| C | 6 | 2 | 4 | ||
| N | 7 | 2 | 5 | ||
| O | 8 | 2 | 6 | ||
| Na | 11 | 2 | 8 | 1 | |
| K | 19 | 2 | 8 | 8 | 1 |
⚛️ ৩.৮ অরবিটাল ও উপঅরবিটাল বিন্যাস
উপঅরবিটাল শক্তির ক্রম:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
উদাহরণ:
Fe (26) = 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s²
🧾 ৩.৯ আইসোটোপ ও পারমাণবিক ভর (Isotopes & Atomic Mass)
আইসোটোপ (Isotopes)
একই মৌলের বিভিন্ন প্রকার পরমাণু যাদের প্রোটন সংখ্যা সমান কিন্তু নিউট্রন সংখ্যা ভিন্ন।
| নাম | প্রতীক | প্রোটন সংখ্যা (Z) | ভর সংখ্যা (A) | নিউট্রন সংখ্যা (A–Z) |
|---|---|---|---|---|
| প্রোটিয়াম | ¹H | 1 | 1 | 0 |
| ডিউটেরিয়াম | ²H | 1 | 2 | 1 |
| ট্রিটিয়াম | ³H | 1 | 3 | 2 |
পারমাণবিক ভর নির্ণয় সূত্র:
[
\text{গড় পারমাণবিক ভর} = \frac{p×m + q×n}{100}
]
উদাহরণ:
Cl এর দুটি আইসোটোপ আছে: ³⁵Cl (75%) এবং ³⁷Cl (25%)
[
\text{গড় ভর} = \frac{(35×75)+(37×25)}{100} = 35.5
]
📒 গুরুত্বপূর্ণ নোটস (Important Notes)
প্রোটন সংখ্যা (Z) = মৌলের পরিচয় নির্দেশ করে।
- নিউট্রন সংখ্যা (N) = A – Z
- ভর সংখ্যা (A) = প্রোটন + নিউট্রন
- ইলেকট্রন বিন্যাস সর্বদা নিম্ন শক্তির অরবিটাল থেকে শুরু হয়।
📘 ২০টি বহুনির্বাচনী প্রশ্ন (MCQ)
- রাদারফোর্ডের পরমাণু মডেল প্রস্তাব করেন —
(a) ১৯১১ খ্রিষ্টাব্দে ✅
(b) ১৯০৫
(c) ১৮৯৮
(d) ১৯২০ - বোরের পরমাণু মডেল প্রস্তাব করেন —
(a) ১৯১৩ ✅
(b) ১৯০৯
(c) ১৯২৫
(d) ১৯৩০ - ইলেকট্রনের চার্জ —
(a) ধনাত্মক
(b) ঋণাত্মক ✅
(c) নিরপেক্ষ
(d) নির্ধারণ করা যায় না - প্ল্যাঙ্ক ধ্রুবক (h)-এর মান —
(a) 6.626×10⁻³⁴ Js ✅
(b) 3×10⁸
(c) 9.11×10⁻³¹
(d) 1.66×10⁻²⁴ - K শক্তিস্তরের সর্বাধিক ইলেকট্রন —
(a) 8
(b) 2 ✅
(c) 18
(d) 32 - L শক্তিস্তরের সর্বাধিক ইলেকট্রন — 8 ✅
- N শক্তিস্তরের সর্বাধিক ইলেকট্রন — 32 ✅
- বোর মডেল ব্যাখ্যা করে — হাইড্রোজেন বর্ণালী ✅
- রাদারফোর্ড মডেলের প্রধান ত্রুটি — ইলেকট্রনের শক্তিক্ষয় ✅
- ³⁷Cl এ প্রোটন সংখ্যা — 17 ✅
- Fe(26)-এর ইলেকট্রন বিন্যাসে 4s² আছে ✅
- পারমাণবিক সংখ্যা Z নির্দেশ করে — প্রোটন সংখ্যা ✅
- আইসোটোপের নিউট্রন সংখ্যা ভিন্ন ✅
- 2n² সূত্রটি দিয়েছেন — বোর ✅
- হাইড্রোজেনের তিনটি আইসোটোপ আছে ✅
- প্রোটন আবিষ্কার করেন — গোল্ডস্টাইন ✅
- নিউট্রন আবিষ্কার করেন — জেমস চ্যাডউইক ✅
- ইলেকট্রন আবিষ্কার করেন — জে. জে. থমসন ✅
- ³⁵Cl এ নিউট্রন সংখ্যা — 18 ✅
- Cl এর গড় পারমাণবিক ভর — 35.5 ✅
নবম-দশম বিজ্ঞান ১০ম অধ্যায় সৃজনশীল প্রশ্ন ও উত্তর [Learn Science]
✍️ সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন:
বোর মডেল কিভাবে রাদারফোর্ড মডেলের ত্রুটি সংশোধন করেছিল? ব্যাখ্যা করো।
উত্তর:
রাদারফোর্ড মডেল অনুযায়ী ইলেকট্রন কক্ষপথে ঘুরলে শক্তি ক্ষয় হয়ে পরমাণু ধ্বসে পড়ার কথা। বোর এই সমস্যা সমাধান করে বলেন—
ইলেকট্রন নির্দিষ্ট কক্ষপথে (stationary orbit) ঘোরে যেখানে শক্তি স্থির থাকে। শক্তি ক্ষয় না হওয়ায় পরমাণু স্থায়ী থাকে।
ইলেকট্রন শুধুমাত্র শক্তিস্তর পরিবর্তনের সময় শক্তি শোষণ বা বিকিরণ করে।
❓প্রায়শ জিজ্ঞাসিত প্রশ্ন (FAQ) পরমাণুর গঠন ও রাদারফোর্ড, বোর মডেল
রাদারফোর্ড মডেল কেন ব্যর্থ হয়?
উত্তর: ইলেকট্রন ঘূর্ণনের সময় শক্তি ক্ষয় হওয়া ও পরমাণু ধ্বস ব্যাখ্যা করতে ব্যর্থ হয়।
উত্তর: হাইড্রোজেনের বর্ণালী ব্যাখ্যা, শক্তিস্তরের ধারণা ও পরমাণুর স্থায়িত্ব ব্যাখ্যা করতে সক্ষম হয়।
উত্তর: প্রতিটি শক্তিস্তরে সর্বাধিক ইলেকট্রন সংখ্যা নির্ণয়ের জন্য।
উত্তর: একই মৌলের বিভিন্ন পরমাণু যাদের প্রোটন সংখ্যা সমান কিন্তু নিউট্রন সংখ্যা ভিন্ন।
উত্তর: প্রাকৃতিক আইসোটোপগুলোর শতকরা উপস্থিতি অনুযায়ী গড় মান নির্ণয় করে।
🧾 উপসংহার
পরমাণুর গঠন সম্পর্কে রাদারফোর্ড ও বোরের অবদান আধুনিক রসায়নের ভিত্তি গঠন করেছে। রাদারফোর্ড আমাদের নিউক্লিয়াসের ধারণা দিয়েছেন, আর বোর শক্তিস্তরের ধারণা দিয়ে পরমাণুর স্থায়িত্ব ব্যাখ্যা করেছেন। আধুনিক কোয়ান্টাম তত্ত্ব এখন আরও গভীরভাবে এই মডেলগুলোর ব্যাখ্যা দেয়।